2022년 9월 13 이슈된 FDA CSA(Computer Software Assurance) 가이던스 초안 번역 내용입니다.
참고해 주시면 되겠습니다.
FDA 컴퓨터 소프트웨어 보증 가이드라인 (2022.09.13. 초안)
I. 소개
FDA는 의료 기기 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 및 자동화된 데이터 처리 시스템에 대한 컴퓨터 소프트웨어 보증에 관한 권장 사항을 제공하기 위해 이 초안 지침을 발행하고 있습니다. 이 초안 지침은 다음을 목적으로 합니다:
생산 또는 품질 시스템에 사용되는 자동화에 대한 신뢰를 구축하기 위한 위험 기반 접근 방식으로서의 "컴퓨터 소프트웨어 보증"을 설명하고, 추가적인 엄격함이 적절할 수 있는 부분을 식별합니다.
컴퓨터 소프트웨어 보증을 확립하고 규제 요구 사항(예: 21 CFR Part 820(Part 820)의 컴퓨터 소프트웨어 검증 요구 사항)을 충족하기 위한 객관적인 증거를 제공하는 데 적용할 수 있는 다양한 방법 및 테스트 활동을 설명합니다.
최종적으로 이 지침은 FDA의 "소프트웨어 검증의 일반 원칙"("소프트웨어 검증 지침")을 보완할 것이며, 이 지침은 소프트웨어 검증 지침의 섹션 6("자동화된 공정 장비 및 품질 시스템 소프트웨어의 검증")을 대체할 것입니다.
이 문서에서 참조하는 FDA 승인된 합의 표준의 최신 버전은 FDA 승인된 합의 표준 데이터베이스를 참조하십시오.
일반적으로 FDA의 지침 문서는 법적 구속력이 있는 책임을 부과하지 않습니다. 대신 지침은 특정 규제 또는 법적 요구 사항이 명시되지 않는 한 주제에 대한 FDA의 현재 생각을 설명하며 권장 사항으로만 간주되어야 합니다. FDA 지침에서 '해야 한다'라는 단어의 사용은 어떤 것이 제안되거나 권장되지만 필수 사항은 아님을 의미합니다.
II. 배경
FDA는 의료 기기 생태계가 제품 품질과 환자 안전을 촉진하는 기기 기능과 제조 관행에 본질적으로 집중하는 미래 상태를 구상하고 있습니다. FDA는 성공적인 제조 관행을 식별하고 홍보하며 기기 제조업체가 제조 품질 수준을 높일 수 있도록 지원하고자 했습니다. 이를 통해 제조업체가 FDA가 시행하는 법률 및 규정에 맞는 고품질 의료 기기를 생산할 수 있도록 돕는 것이 목표 중 하나입니다. 완성된 의료 기기의 제조업체는 Part 820이 적용되는 작업에 참여하는 한 품질 시스템 규정 Part 820을 준수해야 합니다. 품질 시스템 규정에는 의료 기기 제조업체가 제품이 사양에 맞는지 확인하기 위해 생산 공정을 개발, 수행, 제어 및 모니터링해야 하는 요구 사항(21 CFR 820.70, 생산 및 공정 제어)이 포함되어 있으며, 여기에는 의도된 용도에 맞게 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 소프트웨어를 검증해야 하는 요구 사항도 포함됩니다(21 CFR 820.70(i) 참조). 모범 사례를 ...
최근 몇 년 동안 자동화, 로봇 공학, 시뮬레이션 및 기타 디지털 기능의 도입을 포함한 제조 기술의 발전으로 제조업체는 오류 원인을 줄이고 자원을 최적화하며 환자 위험을 줄일 수 있게 되었습니다. FDA는 이러한 기술이 의료 기기의 품질, 가용성 및 안전성을 향상시키는 데 상당한 이점을 제공할 가능성이 있음을 인식하고 그러한 기술의 채택 및 사용을 촉진하기 위해 여러 노력을 기울였습니다.
특히 FDA는 의료 기기 혁신 컨소시엄(MDIC), 의료 기기 제조업체 방문, 자동차, 소비자 전자 제품 등 다른 산업과의 벤치마킹 노력을 통해 이해 관계자와 협력하여 최신 기술을 파악하고 이해 관계자의 과제와 추가 발전 기회를 더 잘 이해하기 위해 노력했습니다. 이러한 지속적인 노력의 일환으로, 의료 기기 제조업체는 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 및 자동화된 데이터 처리 시스템에 대한 소프트웨어 검증에 대한 FDA의 기대 사항에 대한 더 명확한 지침을 원한다고 표현했습니다.
소프트웨어의 빠르게 변화하는 특성 때문에, 제조업체는 또한 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 소프트웨어 검증에 대한 보다 반복적이고 민첩한 접근 방식을 원하고 있습니다.
전통적으로 소프트웨어 검증은 소프트웨어 개발 수명 주기의 각 단계에서 수행되는 소프트웨어 테스트 및 기타 검증 활동을 통해 이루어졌습니다. 그러나 FDA의 소프트웨어 검증 지침에서 설명한 바와 같이, 소프트웨어 테스트만으로는 소프트웨어가 의도된 용도에 적합하다는 신뢰를 구축하기에 충분하지 않은 경우가 많습니다. 대신 소프트웨어 검증 지침에서는 "소프트웨어 품질 보증"이 소프트웨어 개발 과정에서 결함이 도입되는 것을 방지하는 데 중점을 두어야 하며 소프트웨어가 의도된 용도에 적합하다는 신뢰를 구축하기 위해 위험 기반 접근 방식을 사용할 것을 권장합니다.
FDA는 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 소프트웨어에 위험 기반 접근 방식을 적용하면 제조업체의 보증 활동을 더 잘 집중시켜 제품 품질을 보장하고 21 CFR 820.70(i)의 검증 요구 사항을 충족하는 데 도움이 될 것이라고 믿습니다. 이러한 이유로, FDA는 이제 의료 기기 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 및 자동화된 데이터 처리 시스템에 대한 컴퓨터 소프트웨어 보증에 관한 권장 사항을 제공하고 있습니다. FDA는 이러한 권장 사항이 환자가 고품질 의료 기기에 접근할 수 있도록 하고 제조업체가 동적이고 빠르게 변화하는 기술 환경에 발맞추는 데 도움이 되며 FDA가 시행하는 법률 및 규정을 준수하도록 촉진할 것이라고 믿습니다.
III. 범위
최종적으로, 이 지침은 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 또는 자동화된 데이터 처리 시스템에 대한 컴퓨터 소프트웨어 보증에 대한 권장 사항을 제공할 예정입니다.
이 지침은 모든 소프트웨어 검증 원칙에 대한 완전한 설명을 제공하려는 것은 아닙니다. FDA는 이전에 소프트웨어 수명 주기의 일환으로 변경 사항을 관리하는 것을 포함한 소프트웨어 검증 원칙을 FDA의 소프트웨어 검증 지침에서 개략적으로 설명했습니다. 이 지침은 소프트웨어 검증 지침에서 논의된 소프트웨어 검증에 대한 위험 기반 접근 방식을 생산 또는 품질 시스템 소프트웨어에 적용합니다. 이 지침은 또한 특정 위험 고려 사항, 허용 가능한 테스트 방법 및 생산 또는 품질 시스템 소프트웨어에 대한 객관적인 증거를 효율적으로 생성하는 방법을 다룹니다.
이 지침은 SiMD(의료 기기의 소프트웨어) 또는 SaMD(의료 기기 소프트웨어)에 적용되는 21 CFR 820.30에 명시된 설계 검증 또는 검증 요구 사항에 대한 권장 사항을 제공하지 않습니다. SiMD 또는 SaMD의 설계 검증 또는 검증에 관한 FDA의 권장 사항에 대한 자세한 내용은 소프트웨어 검증 지침을 참조하십시오.
IV. 컴퓨터 소프트웨어 보증
컴퓨터 소프트웨어 보증은 소프트웨어가 의도된 용도에 적합하다는 신뢰를 구축하고 유지하기 위한 위험 기반 접근 방식입니다.
이 접근 방식은 소프트웨어가 의도한 대로 작동하지 않을 경우 기기의 안전 및/또는 품질이 손상될 위험을 고려하여 소프트웨어에 대한 신뢰를 구축하기 위해 적절한 수준의 보증 노력 및 활동을 결정합니다. 컴퓨터 소프트웨어 보증 노력이 위험 기반이기 때문에 검증의 부담은 위험을 해결하는 데 필요한 수준 이상으로 증가하지 않습니다. 이러한 접근 방식은 자원의 효율적인 사용을 지원하여 제품 품질을 촉진합니다.
또한, 컴퓨터 소프트웨어 보증은 생산 또는 품질 시스템에서 사용되는 소프트웨어가 수명 주기 동안 통제 상태("검증된 상태")를 유지하도록 설정하고 유지합니다. 이는 제조업체가 점점 더 컴퓨터 및 자동화된 처리 시스템을 사용하여 생산을 모니터링 및 운영하고, 책임 있는 인력에게 알리고, 생산 데이터를 전송 및 분석하는 등 여러 용도로 사용하기 때문에 중요합니다. 제조업체가 위험 기반 테스트, 비스크립트 테스트, 지속적인 성능 모니터링, 데이터 모니터링, 기타 엔터티(예: 개발자, 공급업체)에 의해 수행된 검증 활동을 활용할 수 있도록 함으로써, 컴퓨터 소프트웨어 보증 접근 방식은 소프트웨어가 21 CFR 820.70(i)에 일관된 검증된 상태를 유지하도록 유연성과 민첩성을 제공합니다.
의도된 용도에 적합하고 검증된 상태를 유지하는 소프트웨어는 의도한 대로 작동하여 완성된 기기가 안전하고 효과적이며 규제 요구 사항을 준수하도록 합니다(21 CFR 820.1(a)(1) 참조). 아래의 섹션 V는 컴퓨터 소프트웨어 보증을 위한 위험 기반 프레임워크를 설명합니다.
V. 컴퓨터 소프트웨어 보증 위험 프레임워크
다음 접근 방식은 제조업체가 소프트웨어 수명 주기 동안 컴퓨터 소프트웨어 보증을 위한 위험 기반 프레임워크를 구축하는 데 도움을 주기 위한 것입니다. 이 위험 프레임워크를 다양한 컴퓨터 소프트웨어 보증 상황에 적용한 예는 부록 A에 제공됩니다.
A. 의도된 용도의 식별(Identifying the Intended Use)
규정에 따라 제조업체는 생산 또는 품질 시스템의 일부로 사용되는 소프트웨어를 의도된 용도로 검증해야 합니다(21 CFR 820.70(i) 참조). 검증 요구 사항이 적용되는지 여부를 결정하려면 제조업체는 먼저 소프트웨어가 생산 또는 품질 시스템의 일부로 사용될 의도가 있는지 확인해야 합니다.
일반적으로 생산 또는 품질 시스템의 일부로 사용되는 소프트웨어는 두 가지 범주 중 하나에 속합니다: 생산 또는 품질 시스템의 일부로 직접 사용되는 소프트웨어와 생산 또는 품질 시스템을 지원하는 소프트웨어.
다음과 같은 의도된 용도로 사용되는 소프트웨어는 생산 또는 품질 시스템의 일부로 직접 사용되는 것으로 간주됩니다:
- 생산 공정, 검사, 테스트 또는 생산 데이터의 수집 및 처리를 자동화하기 위한 소프트웨어; 및
- 품질 시스템 프로세스, 품질 시스템 데이터의 수집 및 처리 또는 품질 시스템 규정에 따라 설정된 품질 기록을 자동화하기 위한 소프트웨어.
다음과 같은 의도된 용도로 사용되는 소프트웨어는 생산 또는 품질 시스템을 지원하기 위해 사용되는 것으로 간주됩니다:
- 생산 또는 품질 시스템의 일부로 사용되는 소프트웨어를 테스트하거나 모니터링하는 개발 도구로 사용되거나, 스크립트를 개발 및 실행하는 데 사용되는 것과 같은 소프트웨어 테스트 활동을 자동화하기 위한 소프트웨어; 및
- 품질 기록의 일부가 아닌 일반 기록 보관을 자동화하기 위한 소프트웨어.
두 가지 종류의 소프트웨어는 모두 생산 또는 품질 시스템의 "일부"로 사용되며 21 CFR 820.70(i)에 따라 검증되어야 합니다. 그러나 아래에서 더 논의된 것처럼, 지원 소프트웨어는 종종 낮은 위험을 수반하므로, 위험 기반 컴퓨터 소프트웨어 보증 접근 방식에 따라 검증 노력은 안전성을 손상시키지 않고 줄일 수 있습니다.
반면, 다음과 같은 의도된 용도로 사용되는 소프트웨어는 일반적으로 생산 또는 품질 시스템의 일부로 사용되지 않는 것으로 간주되며, 따라서 21 CFR 820.70(i)의 검증 요구 사항이 적용되지 않습니다:
- 일반 비즈니스 프로세스 또는 운영 관리를 위한 소프트웨어(예: 이메일 또는 회계 응용 프로그램); 및
- 생산 또는 품질 시스템과 관련이 없는 인프라를 구축하거나 지원하기 위한 소프트웨어(예: 네트워킹 또는 운영 연속성).
FDA는 생산 또는 품질 시스템에서 사용되는 소프트웨어가 종종 여러 기능, 역할 및 작업으로 구성된 복잡한 소프트웨어이며, 이러한 소프트웨어는 개별 기능, 역할 및 작업에 따라 하나 이상의 의도된 용도를 가질 수 있음을 인식하고 있습니다. 개별 기능, 역할 및 작업이 생산 또는 품질 시스템 내에서 서로 다른 역할을 하는 경우, 이는 서로 다른 수준의 검증 노력을 필요로 하는 다양한 위험을 나타낼 수 있습니다. FDA는 제조업체가 개별 기능, 역할 및 작업의 의도된 용도를 조사하여 위험 기반 보증 전략을 개발할 것을 권장합니다. 제조업체는 개별 기능, 역할 또는 작업에 대해 다른 보증 활동을 수행하기로 결정할 수 있습니다.
예를 들어, 상용 오프 더 쉘프(COTS) 스프레드시트 소프트웨어는 다양한 의도된 용도로 여러 기능을 포함할 수 있습니다. COTS 스프레드시트 소프트웨어의 기본 입력 기능을 경화 공정의 시간 및 온도 기록을 문서화하는 용도로 사용하는 경우, 제조업체는 COTS 소프트웨어 개발자와 초기 설치 및 구성에서 수행한 보증 활동 외에 추가적인 보증 활동을 수행할 필요가 없을 수 있습니다. 소프트웨어의 의도된 용도인 "기록 문서화"는 품질 시스템 기록 유지에만 사용되며 낮은 공정 위험을 나타냅니다.
따라서, 공급업체 평가, 소프트웨어 설치 및 구성과 같은 초기 활동만으로 소프트웨어가 의도된 용도에 적합하고 검증된 상태를 유지하는지 확인하는 데 충분할 수 있습니다. 그러나 제조업체가 COTS 스프레드시트의 기본 제공 기능을 사용하여 맞춤형 공식을 생성하고 이를 생산 또는 품질 시스템에 직접 사용하는 경우, 추가적인 위험이 발생할 수 있습니다. 예를 들어, 맞춤형 공식이 경화 공정의 성능 및 적합성을 모니터링하기 위해 시간 및 온도 통계를 자동으로 계산하는 경우, 제조업체는 추가적인 검증을 수행해야 할 수 있습니다.
이 지침의 목적을 위해, 우리는 소프트웨어의 개별 기능, 역할 또는 작업의 의도된 용도를 조사하여 컴퓨터 소프트웨어 보증 프레임워크를 설명하고 권장합니다. 그러나 소프트웨어가 하나의 의도된 용도만 있는 간단한 경우(예: 소프트웨어 내의 모든 기능, 역할 및 작업이 동일한 의도된 용도를 공유하는 경우), 제조업체는 각 기능, 역할 및 작업을 개별적으로 조사하는 것이 도움이 되지 않을 수 있습니다. 이러한 경우, 제조업체는 위험 기반 접근 방식을 개발하고 소프트웨어의 전체 의도된 용도를 기반으로 보증 활동을 고려할 수 있습니다.
FDA는 제조업체가 소프트웨어 기능, 역할 또는 작업이 생산 또는 품질 시스템의 일부로 사용될 의도인지 여부를 결정하는 의사 결정 과정을 표준 운영 절차(SOP)에 문서화할 것을 권장합니다.
B. 위험 기반 접근 방식 결정 (Determining the Risk-Based Approach)
제조업체가 소프트웨어 기능, 역할 또는 작업이 생산 또는 품질 시스템의 일부로 사용될 의도인지 여부를 결정한 후, FDA는 적절한 보증 활동을 결정하기 위해 위험 기반 분석을 사용할 것을 권장합니다. 이 위험 기반 접근 방식은 일반적으로 예측 가능한 소프트웨어 실패를 체계적으로 식별하고, 이러한 실패가 높은 공정 위험을 초래하는지 여부를 결정하며, 의료 기기 또는 공정 위험에 상응하는 보증 활동을 체계적으로 선택하고 수행하는 것을 포함합니다.
생산 또는 품질 시스템 소프트웨어에 대한 컴퓨터 소프트웨어 보증을 위한 위험 기반 분석을 수행하는 것은 ISO 14971:2019 – 의료 기기 – 의료 기기에 대한 위험 관리의 적용에 설명된 의료 기기에 대한 위험 분석을 수행하는 것과 다릅니다. ISO 14971:2019에서 분석한 위험(의료 기기 위험)과 달리, 생산 또는 품질 시스템 소프트웨어가 의도한 대로 작동하지 않을 경우의 실패는 과거 데이터나 모델링을 기반으로 특정 위험의 발생 가능성을 추정할 수 있는 확률적 방식으로 발생하지 않습니다.
대신, 생산 또는 품질 시스템 소프트웨어에 대한 위험 기반 분석은 소프트웨어가 의도한 대로 작동하지 못하게 하거나 작동을 방해할 수 있는 요인들(예: 적절한 시스템 구성 및 관리, 시스템 보안, 데이터 저장, 데이터 전송 또는 운영 오류)을 고려합니다. 따라서, 생산 또는 품질 시스템 소프트웨어에 대한 위험 기반 분석은 어떤 실패가 예측 가능(가능성 있는)하고 각 실패로 인한 위험을 고려해야 합니다. 이 지침에서는 공정 위험(Process Risks)과 의료 기기 위험(Medial device risks) 모두를 다룹니다. 공정 위험은 생산 또는 품질 시스템을 손상시킬 가능성을 나타내며, 의료 기기 위험은 기기가 환자 또는 사용자에게 해를 입힐 가능성을 나타냅니다. 의료 기기 위험을 논의할 때, 이 지침은 안전성을 손상시키는 품질 문제로 인한 의료 기기 위험에 중점을 둡니다.
특히, FDA는 소프트웨어 기능, 역할 또는 작업이 의도한 대로 수행되지 않을 경우 예측 가능하게 안전성을 손상시키는 품질 문제를 초래할 때 높은 공정 위험을 초래하는 것으로 간주합니다. 이는 의료 기기 위험이 증가한다는 의미입니다. 이 공정 위험 식별 단계는 환자나 사용자에게 미치는 의료 기기 위험이 아닌 공정 자체에 초점을 맞춥니다. 일반적으로 높은 공정 위험을 초래하는 소프트웨어 기능, 역할 또는 작업의 예는 다음과 같습니다:
- 제품 또는 제조 공정의 물리적 특성에 영향을 미치는 공정 매개변수(예: 온도, 압력, 습도)를 유지 관리하는 소프트웨어;
- 추가적인 인간 인식이나 검토 없이 제품 또는 공정의 적합성을 측정, 검사, 분석 및/또는 결정하는 소프트웨어;
- 추가적인 인간 인식이나 검토 없이 데이터 모니터링 또는 다른 공정 단계의 자동 피드백을 기반으로 공정 매개변수의 수정 또는 조정을 수행하는 소프트웨어;
- 의료 기기의 안전한 작동에 필요한 환자 및 사용자에게 제공되는 사용 지침 또는 기타 라벨을 생성하는 소프트웨어;
- 제조업체가 의료 기기 안전 및 품질에 필수적이라고 식별한 데이터를 자동으로 감시, 추세 분석 또는 추적하는 소프트웨어.
반면, FDA는 소프트웨어 기능, 역할 또는 작업이 의도한 대로 수행되지 않더라도 안전성을 예측 가능하게 손상시키는 품질 문제를 일으키지 않는 경우 높은 공정 위험을 초래하지 않는 것으로 간주합니다. 여기에는 소프트웨어가 의도한 대로 수행되지 않더라도 품질 문제가 발생하지 않는 상황뿐만 아니라, 의도한 대로 수행되지 않더라도 예측 가능하게 안전성을 손상시키지 않는 품질 문제가 발생하는 상황도 포함됩니다. 일반적으로 높은 공정 위험을 초래하지 않는 소프트웨어 기능, 역할 또는 작업의 예는 다음과 같습니다:
- 생산 또는 공정 성과에 직접적인 영향을 미치지 않고 모니터링 및 검토 목적으로 공정 데이터를 수집하고 기록하는 소프트웨어;
- 시정 및 예방 조치(CAPA) 라우팅, 불만 사항의 자동 로깅/추적, 자동 변경 관리, 또는 자동 절차 관리와 같은 품질 시스템의 일부로 사용되는 소프트웨어;
- 데이터를 관리(처리, 저장 및/또는 조직)하거나, 기존 계산을 자동화하거나, 공정 모니터링을 증가시키거나, 설정된 공정에서 예외가 발생할 때 경고를 제공하도록 의도된 소프트웨어;
- 섹션 V- A.항목에서 설명한 대로 생산 또는 품질 시스템을 지원하는 데 사용되는 소프트웨어.
FDA는 생산 또는 품질 시스템의 일부로 사용되는 소프트웨어와 관련된 공정 위험이 높은 위험에서 낮은 위험에 이르는 스펙트럼에 있음을 인정합니다. 제조업체는 소프트웨어의 의도된 용도에 따라 각 소프트웨어 기능, 역할 또는 작업의 위험을 해당 스펙트럼에 따라 결정해야 합니다. 그러나 FDA는 높은 공정 위험을 초래하는 소프트웨어 기능, 역할 및 작업에 대한 검토 및 보증에 주로 관심을 가지고 있습니다. 따라서 이 지침의 목적을 위해, FDA는 공정 위험을 "높은 공정 위험"과 "높지 않은 공정 위험"의 이진 방식으로 제시하고 있습니다. 제조업체는 보증 활동을 결정할 때 공정 위험을 "중간", "중간 정도", 또는 "낮음"으로 결정할 수 있으며, 이 경우 이 지침의 "높지 않은 공정 위험"에 관한 부분이 적용됩니다. 아래 섹션 V-C.항목 에서 논의된 대로, 보증 활동은 위험에 상응하여 "높은 공정 위험"과 "높지 않은 공정 위험" 소프트웨어에 대해 수행해야 합니다.
예시 1:
ERP(Enterprise Resource Planning) 관리 시스템에는 제조 자재 재고를 자동으로 보충하는 기능이 포함되어 있습니다. 이 기능은 적절한 생산 작업에 필요한 자재가 올바르게 주문되고 배송되도록 합니다. 그러나 자재가 생산에 사용되기 전에 자격을 갖춘 인원이 자재를 확인합니다. 이 기능이 의도한 대로 수행되지 않으면 잘못된 자재가 재고 및 배송되는 품질 문제가 발생할 수 있습니다. 그러나 잘못된 자재가 자격을 갖춘 인원에게 배송되면 해당 자재는 사용 전에 거부되어야 하므로 품질 문제가 예측 가능하게 안전성을 손상시키지 않습니다. 제조업체는 이를 중간(높지 않은) 공정 위험으로 식별하고 공정 위험에 상응하는 보증 활동을 결정합니다. 제조업체는 이미 일부 식별된 보증 활동을 수행하고 있으므로 나머지 식별된 보증 활동만 구현합니다.
예시 2:
다른 ERP 관리 시스템의 유사한 기능은 이전 예시와 동일한 작업을 수행하지만, 자재가 생산에 사용되기 전에 확인하는 작업도 자동화합니다. 자격을 갖춘 인원이 자재를 먼저 확인하지 않습니다. 제조업체는 이 기능이 의도한 대로 수행되지 않으면 예측 가능하게 안전성을 손상시키는 품질 문제를 초래할 수 있으므로 높은 공정 위험으로 식별합니다. 따라서 제조업체는 관련 의료 기기 위험에 상응하는 보증 활동을 결정합니다. 제조업체는 이미 일부 식별된 보증 활동을 수행하고 있으므로 나머지 식별된 보증 활동만 구현합니다.
예시 3:
ERP 관리 시스템에는 제품 배송을 자동화하는 기능이 포함되어 있습니다. 의료 기기 위험은, 다른 요인들 중에서도, 올바른 제품이 기기 사용자에게 배송되는지 여부에 따라 달라집니다. 이 기능이 의도한 대로 수행되지 않으면 잘못된 제품이 배송되는 품질 문제가 발생하여 예측 가능하게 안전성을 손상시킬 수 있으므로, 제조업체는 이를 높은 공정 위험으로 식별합니다. 실패가 안전성을 손상시킬 수 있으므로, 제조업체는 관련 의료 기기 위험 증가를 결정하고 이에 상응하는 보증 활동을 식별합니다. 이 경우, 제조업체는 아직 식별된 보증 활동을 구현하지 않았으므로 분석에서 식별된 모든 보증 활동을 구현합니다.
예시 4:
생산 소프트웨어의 자동화된 그래픽 사용자 인터페이스(GUI) 기능은 사용자 상호 작용을 기반으로 테스트 스크립트를 개발하고, 생산 시스템의 사용자 인터페이스 수정 사항을 자동으로 테스트하기 위해 사용됩니다. 이 GUI 기능이 의도한 대로 수행되지 않으면 구현 중단 및 생산 시스템 업데이트 지연이 발생할 수 있지만, 이 경우 GUI 기능이 별도의 테스트 환경에서 작동하므로 이러한 오류가 예측 가능하게 안전성을 손상시키지 않습니다. 제조업체는 이를 낮은(높지 않은) 공정 위험으로 식별하고 공정 위험에 상응하는 보증 활동을 결정합니다. 제조업체는 이미 일부 식별된 보증 활동을 수행하고 있으므로 나머지 식별된 보증 활동만 구현합니다.
FDA의 "30일 공지, 135일 시판 전 승인(PMA) 보충 및 75일 인도적 기기 면제(HDE) 보충을 위한 제조 방법 또는 공정 변경" 지침에 언급된 바와 같이, PMA 또는 HDE에 해당하는 기기의 경우, 기기의 안전성이나 유효성에 영향을 미치지 않는 제조 절차나 제조 방법의 변경은 주기 보고서(일반적으로 연간 보고서라고 함)로 제출해야 합니다. 반면, 기기의 안전성과 유효성에 영향을 미치는 제조 절차나 제조 방법의 수정은 30일 공지로 제출해야 합니다. 제조 절차나 제조 방법의 변경에는 생산 또는 품질 시스템에서 사용되는 소프트웨어 변경이 포함될 수 있습니다. PMA 또는 HDE에 해당하는 기기의 생산 또는 품질 시스템에서 사용되는 소프트웨어에 추가되거나 변경된 경우, FDA는 제조업체가 변경이 기기의 안전성이나 유효성에 영향을 미칠 수 있는지 여부를 결정하는 데 위에서 설명한 원칙을 적용할 것을 권장합니다. 일반적으로, 변경이 예측 가능하게 안전성을 손상시키는 품질 문제를 초래할 수 있는 경우, 30일 공지로 제출해야 합니다. 변경이 예측 가능하게 안전성을 손상시키는 품질 문제를 초래하지 않는 경우, 연간 보고서가 적절할 수 있습니다.
예를 들어, MES(Manufacturing Execution System)는 워크플로우를 관리하고, 진행 상황을 추적하며, 데이터를 기록하고, 검증된 매개변수를 기반으로 경고 또는 임계값을 설정하는 데 사용될 수 있으며, 이는 품질 시스템 유지의 일부입니다. 이러한 MES가 의도한 대로 수행되지 않으면 운영이 중단될 수 있지만, 안전하고 효과적인 기기를 생산하기 위해 설정된 공정 매개변수에는 영향을 미치지 않습니다. 이러한 MES 운영에 영향을 미치는 변경은 일반적으로 연간 보고서로 간주됩니다. 반면, 설정된 중요한 생산 매개변수(예: 온도, 압력, 공정 시간)를 자동으로 제어하고 조정하는 데 사용되는 MES는 기기의 안전성이나 유효성에 영향을 미치는 제조 절차 변경일 수 있습니다. 이 경우, 이러한 특정 작업에 영향을 미치는 변경은 30일 공지를 요구할 수 있습니다.
C. 적절한 보증 활동 결정 (Determining the Appropriate Assurance Activites)
제조업체가 소프트웨어 기능, 역할 또는 작업이 높은 공정 위험(예측 가능하게 안전성을 손상시킬 수 있는 품질 문제)을 초래하는지 여부를 결정한 후, 제조업체는 의료 기기 위험 또는 공정 위험에 상응하는 보증 활동을 식별해야 합니다. 품질 문제가 예측 가능하게 안전성을 손상시킬 수 있는 경우(높은 공정 위험), 보증 수준은 의료 기기 위험에 상응해야 합니다. 품질 문제가 예측 가능하게 안전성을 손상시키지 않을 경우(높지 않은 공정 위험), 보증 엄격성 수준은 공정 위험에 상응해야 합니다. 어떤 경우든, 소프트웨어 기능, 역할 또는 작업의 위험이 높을수록 더 많은 객관적인 증거를 수집해야 합니다. 반대로, 안전성 및/또는 품질이 상대적으로 낮은 위험(즉, 높지 않은 공정 위험)일 경우, 컴퓨터 소프트웨어 보증 노력에 대한 객관적인 증거 수집이 줄어듭니다.
환자나 사용자에게 심각한 해를 입힐 수 있는 기능, 역할 또는 작업은 일반적으로 높은 기기 위험으로 간주됩니다. 반면, 심각한 해를 예측 가능하게 초래하지 않는 기능, 역할 또는 작업은 높은 기기 위험으로 간주되지 않을 수 있습니다. 어떤 경우든, 소프트웨어가 의도한 대로 작동하지 않을 경우의 위험은 그에 상응하는 의료 기기 위험과 일치합니다.
제조업체가 소프트웨어 기능, 역할 또는 작업이 높은 공정 위험을 초래하지 않는다고 결정한 경우(즉, 안전성을 예측 가능하게 손상시키는 품질 문제를 초래하지 않을 경우), 제조업체는 공정, 즉 생산 또는 품질 시스템과 관련된 위험을 고려해야 합니다. 이는 실패가 안전성을 손상시키지 않으므로 추가적인 의료 기기 위험을 도입하지 않기 때문입니다. 예를 들어, 공정 데이터를 수집하고 검토하기 위해 기록하는 기능은 검토자의 검토 전에 제품의 적합성을 결정하는 기능보다 낮은 공정 위험을 초래할 수 있습니다.
제조업체가 일반적으로 수행하는 보증 활동의 유형에는 다음이 포함되지만 이에 국한되지는 않습니다:
• 비스크립트 테스트 – 테스트 케이스의 서면 지침에 의해 테스트 수행자의 작업이 미리 정해지지 않은 동적 테스트입니다. 여기에는 다음이 포함됩니다:
- 애드혹 테스트 – 많은 양의 문서(예: 테스트 절차)를 사용하지 않고 테스트를 수행하는 데 중점을 둔 비스크립트 실습에서 파생된 개념입니다.
- 오류 추측 – 테스트 케이스가 이전 실패 사례나 일반적인 실패 모드에 대한 테스트 수행자의 지식을 기반으로 파생되는 테스트 설계 기법입니다.
- 탐색적 테스트 – 테스트 수행자가 기존의 관련 지식, 테스트 항목에 대한 사전 탐색(이전 테스트 결과 포함) 및 일반적인 소프트웨어 동작 및 실패 유형에 관한 휴리스틱 "경험 법칙"을 기반으로 자발적으로 테스트를 설계하고 실행하는 경험 기반 테스트입니다. 탐색적 테스트는 숨겨진 속성, 즉 숨겨진 예상치 못한 사용자 동작이나 다른 소프트웨어 속성에 간섭할 수 있는 우발적인 사용 상황을 찾아 소프트웨어 실패의 위험을 초래할 수 있습니다.
• 스크립트 테스트 – 테스트 케이스의 서면 지침에 따라 테스트 수행자의 작업이 정해진 동적 테스트입니다. 스크립트 테스트에는 강력한 스크립트 테스트와 제한된 스크립트 테스트가 포함됩니다.
- 강력한 스크립트 테스트 – 컴퓨터 시스템이나 자동화의 위험이 반복 가능성, 요구 사항에 대한 추적 가능성, 감사 가능성의 증거를 포함하는 스크립트 테스트 노력입니다.
- 제한된 스크립트 테스트 – 컴퓨터 시스템이나 자동화의 위험에 따라 적절하게 확장된 스크립트 테스트와 비스크립트 테스트의 하이브리드 접근 방식입니다. 이 접근 방식은 고위험 기능이나 작업에 대해 스크립트 테스트를 적용하고, 동일한 보증 노력의 일부로 중저위험 항목에 대해 비스크립트 테스트를 적용할 수 있습니다.
일반적으로, FDA는 제조업체가 적절한 활동을 결정하기 위해 관리, 선택, 우선순위 설정 및 테스트 활동과 자원의 사용을 분석된 위험의 유형과 수준에 따라 의식적으로 기반으로 하는 위험 기반 테스트 원칙을 적용할 것을 권장합니다. 고위험 소프트웨어 기능, 역할 및 작업에 대해서는 제조업체가 보증 활동을 결정할 때 스크립트 테스트나 제한된 스크립트 테스트의 사용과 같은 더 많은 엄격성을 고려할 수 있습니다. 반면, 고위험이 아닌 소프트웨어 기능, 역할 및 작업에 대해서는 제조업체가 애드혹 테스트, 오류 추측, 탐색적 테스트와 같은 비스크립트 테스트 방법이나 의도된 사용의 위험에 적합한 방법의 조합을 고려할 수 있습니다.
적절한 보증 활동을 결정할 때, 제조업체는 소프트웨어 기능, 역할 또는 작업의 실패가 발생할 경우 안전성 및/또는 품질의 손상을 줄일 수 있는 추가적인 제어 장치나 메커니즘이 품질 시스템 전반에 걸쳐 있는지 여부를 고려해야 합니다. 예를 들어, 종합적인 보증 접근 방식의 일환으로, 제조업체는 다음을 활용하여 추가적인 보증 활동의 노력을 줄일 수 있습니다:
- 생산을 지원하는 데이터의 무결성을 보장하거나 다른 조직 단위에서 수행한 소프트웨어 품질 보증 프로세스와 같은 생산에서 제어를 제공하는 활동, 인력 및 확립된 프로세스.
- 소프트웨어 개발자를 선택하고 모니터링하기 위한 확립된 구매 제어 프로세스. 예를 들어, 제조업체는 소프트웨어 개발자가 이미 수행한 관행, 검증 작업 및 전자 정보를 출발점으로 삼고 추가적으로 필요한 활동을 결정할 수 있습니다. 일부 저위험 소프트웨어 기능, 역할 및 작업에 대해서는 이것이 제조업체에 필요한 모든 보증일 수 있습니다.
- 생산 전반에 걸쳐 통합된 추가 공정 제어. 예를 들어, 공정이 완전히 이해되고 모든 중요한 공정 매개변수가 모니터링되며/또는 공정의 모든 출력이 검증 테스트를 거친다면, 이러한 제어는 소프트웨어 기능, 역할 또는 작업이 의도한 대로 수행되지 않을 경우 발생할 수 있는 품질 문제를 감지하고 수정하는 추가 메커니즘으로 작용할 수 있습니다. 이 예에서, 이러한 제어의 존재는 소프트웨어에 적합한 보증 활동의 노력을 줄이는 데 활용될 수 있습니다.
- 소프트웨어 구현 후 소프트웨어의 문제 및 이상을 모니터링하거나 감지하기 위해 소프트웨어가 주기적으로 또는 지속적으로 수집하는 데이터 및 정보. 성능 문제나 편차 및 시스템 오류를 모니터링하고 감지하는 기능은 소프트웨어가 의도한 대로 수행되지 않을 경우와 관련된 위험을 줄일 수 있으며, 보증 활동을 결정할 때 고려될 수 있습니다.
- 가능할 때마다 생산 또는 품질 시스템의 일부로 사용되는 소프트웨어의 보증을 위한 컴퓨터 시스템 검증 도구(예: 버그 추적기, 자동화된 테스트)의 사용.
- 생산 또는 품질 시스템의 일부로 사용되는 소프트웨어의 수명 주기 전반에 걸쳐 반복 주기 및 지속적인 테스트의 사용.
예를 들어, 섹션 V-A.항 에서 언급한 지원 소프트웨어는 종종 낮은 위험을 수반하므로 보증 노력이 일반적으로 이에 따라 줄어들 수 있습니다. 생산 또는 품질 시스템에서 "직접" 사용되는 보증 활동은 종종 지원 소프트웨어의 성능을 본질적으로 다루기 때문에, 이 지원 소프트웨어가 의도한 대로 수행되는지 보증하는 것은 공급업체 검증 기록, 소프트웨어 설치 또는 소프트웨어 구성 활용만으로 충분히 확립될 수 있으며, 추가적인 보증 활동(예: 스크립트 또는 비스크립트 테스트)은 불필요할 수 있습니다.
제조업체는 소프트웨어 기능, 역할 또는 작업이 검증된 상태를 유지하도록 보증 활동을 결정할 책임이 있습니다. 위에서 언급한 보증 활동과 고려 사항은 보증을 제공하는 몇 가지 가능한 방법이며, 처방적이거나 포괄적이지 않습니다. 제조업체는 의도된 용도와 관련된 위험에 가장 적합한 활동이나 활동의 조합을 활용할 수 있습니다.
D. 적절한 기록 수립 (Establishing the Appropriate Record)
기록을 수립할 때, 제조업체는 소프트웨어 기능, 역할 또는 작업이 평가되었고 의도된 대로 수행되었다는 충분한 객관적인 증거를 포착해야 합니다. 일반적으로, 기록에는 다음이 포함되어야 합니다:
- 소프트웨어 기능, 역할 또는 작업의 의도된 용도
- 소프트웨어 기능, 역할 또는 작업의 위험 결정
- 수행된 보증 활동의 문서화, 포함:
- 보증 활동에 기반한 테스트 설명
- 발견된 문제(예: 일탈, 실패) 및 그 처리
- 결과의 수용 가능성을 선언하는 결론 성명
- 테스트/평가의 날짜와 수행자의 이름
- 적절한 경우 확립된 검토 및 승인(예: 필요한 경우 서명 권한이 있는 개인의 서명과 날짜)
보증 활동 문서화는 식별된 위험에 대해 소프트웨어 기능, 역할 또는 작업이 의도된 대로 수행된다는 것을 보여주는 데 필요한 증거 이상을 포함할 필요는 없습니다. FDA는 기록이 개선의 기준선 또는 문제가 발생할 경우 참조점으로 사용할 수 있도록 보증 활동의 충분한 세부 사항을 유지할 것을 권장합니다.
표 1은 섹션 V-C.항 에서 식별된 위험 기반 테스트 접근 방식을 사용할 때 기록을 구현하고 개발하는 몇 가지 예를 제공합니다. 제조업체는 대안적인 접근 방식을 사용하고 다른 문서를 제공할 수 있으며, 해당 접근 방식이 관련 법적 문서 요구 사항을 충족하는 한 허용됩니다.
표 1

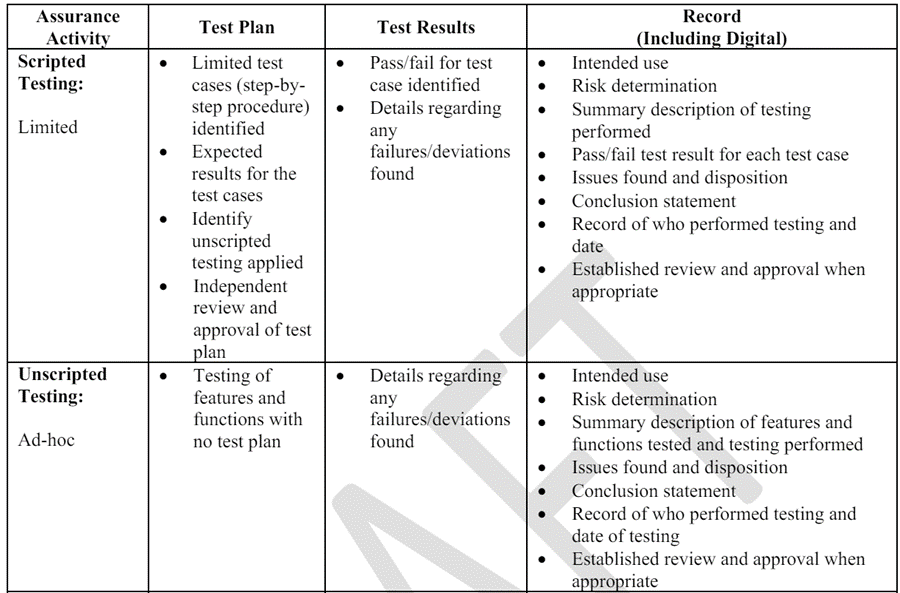
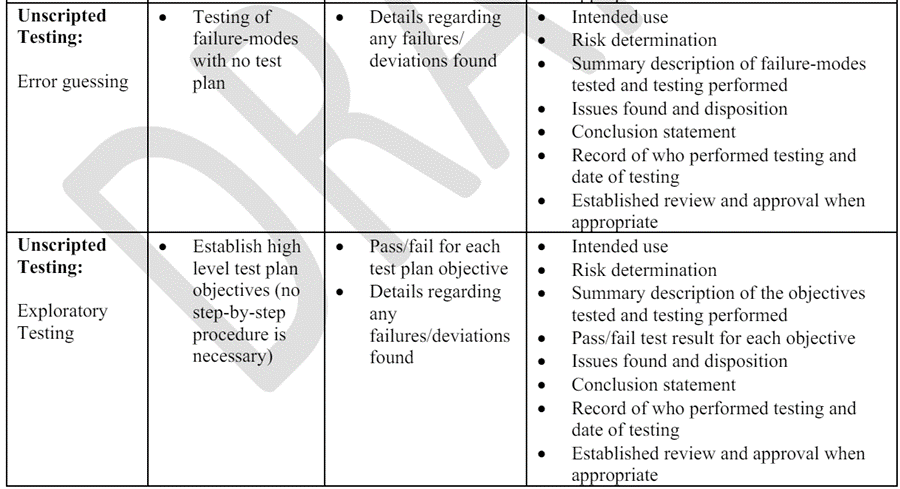
다음은 제조업체가 통제된 시스템에 저장된 비일치 데이터를 수집하고 그래프를 작성하는 용도로 스프레드시트를 개발한 시나리오에서 보증 기록의 예입니다. 이 예에서, 제조업체는 비일치 제품이 출시되지 않도록 추가적인 공정 제어와 검사를 설정했습니다. 이 경우, 스프레드시트가 의도한 대로 수행되지 않더라도 예측 가능하게 안전성을 손상시키는 품질 문제가 발생하지 않으므로, 스프레드시트는 높은 공정 위험을 초래하지 않습니다. 제조업체는 스프레드시트에서 사용된 특정 기능을 신속하게 탐색적 테스트를 수행하여 분석을 생성, 읽기, 업데이트 및/또는 삭제할 수 있는지 확인했습니다. 탐색적 테스트 동안 모든 계산된 필드는 올바르게 업데이트되었지만 업데이트 테스트 중에 한 가지 일탈이 발생했습니다. 이 시나리오에서 기록은 다음과 같이 문서화됩니다:
• 의도된 용도: 스프레드시트는 통제된 시스템에 저장된 비일치 데이터를 수집하고 그래프를 작성하는 용도로 사용됩니다. 따라서, 이는 생산 또는 품질 시스템의 일부로 사용됩니다. 이 사용 때문에, 스프레드시트는 회계와 같은 비즈니스 운영에 사용되는 유사한 소프트웨어와 다릅니다.
• 위험 기반 분석: 이 경우, 소프트웨어는 비일치 데이터를 수집하고 표시하는 데만 사용되며, 제조업체는 비일치 제품이 출시되지 않도록 추가적인 공정 제어와 검사를 설정했습니다. 따라서, 스프레드시트가 의도한 대로 수행되지 않더라도 예측 가능하게 안전성을 손상시키는 품질 문제가 발생하지 않습니다. 따라서, 소프트웨어는 높은 공정 위험을 초래하지 않으며, 보증 활동은 공정 위험에 상응해야 합니다.
• 테스트: 스프레드시트 X, 버전 1.2
• 테스트 유형: 비스크립트 테스트 – 탐색적 테스트
• 목표: 분석을 올바르게 생성, 읽기, 업데이트 및 삭제할 수 있는지 확인
• 테스트 목표 및 활동:
- 새로운 분석 생성 – 통과
- 필요한 소스에서 데이터 읽기 – 통과
- 분석의 데이터 업데이트 – 입력 오류로 인해 실패, 이후 통과
- 데이터 삭제 – 통과
- 관찰을 통해 모든 계산된 필드가 변경 사항에 올바르게 업데이트되는지 확인 – 편차가 기록된 상태로 통과
• 일탈: 업데이트 테스트 중, 사용자가 숫자 데이터가 필요한 업데이트 가능한 필드에 텍스트를 잘못 입력한 경우, 관련 행에 즉시 오류가 표시되었습니다.
• 결론: 일탈 외에는 스프레드시트 기능에서 오류가 관찰되지 않았습니다. 필드에 텍스트를 잘못 입력하면 즉시 표시되며, 이는 의도된 사용의 위험에 영향을 미치지 않습니다. 또한, 해당 필드에 숫자 데이터 입력만 허용하는 검증 규칙이 적용되었습니다.
• 언제/누가: 2019년 7월 9일, 제인 스미스
디지털 기술의 발전으로 인해 제조업체는 결과를 문서화하기 위해 수행된 작업의 자동 추적, 테스트 및 전자 기록을 활용하여 수동 또는 종이 기반 문서화의 필요성을 줄일 수 있습니다. 최소한의 부담을 주는 방법으로, FDA는 보증 활동과 관련된 기록을 수립할 때 종이 문서나 스크린샷 대신 시스템 로그, 감사 추적 및 소프트웨어가 생성한 기타 데이터를 포함한 전자 기록을 사용할 것을 권장합니다.
제조업체는 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 또는 자동화된 데이터 처리 시스템에 Part 11, 전자 기록; 전자 서명 적용에 관한 혼란과 우려를 표명했습니다. "Part 11, 전자 기록; 전자 서명 – 범위 및 적용" 지침에 설명된 바와 같이, FDA는 전자 기록을 생성, 수정, 유지 관리 또는 전송하는 데 사용되는 전산 시스템의 검증에 대한 Part 11 요구 사항에 대해 시행 재량을 행사할 예정입니다(21 CFR 11.10(a) 및 11.30 참조). 일반적으로, Part 11은 FDA 규정에 명시된 기록 요구 사항에 따라 생성, 수정, 유지 관리, 보관, 검색 또는 전송되는 전자 형태의 기록에 적용됩니다(21 CFR 11.1(b) 참조). Part 11은 또한 FDA 규정에 명시되지 않은 경우에도, 연방 식품, 의약품 및 화장품법(FD&C Act) 및 공중 보건 서비스법(PHS Act)에 따라 FDA에 제출된 전자 기록에 적용됩니다(21 CFR 11.1(b) 참조).
컴퓨터 또는 자동화된 데이터 처리 시스템의 맥락에서, 생산 또는 품질 시스템의 일부로 사용되는 컴퓨터 소프트웨어의 경우, Part 820에 따라 요구되는 문서가 전자 형태로 유지되는 경우, 이는 일반적으로 Part 11의 의미 내에서 "전자 기록"에 해당합니다(21 CFR 11.3(b)(6) 참조). 예를 들어, Part 820에 따라 서명이 요구되는 문서가 전자 형태로 유지되는 경우, Part 11이 적용됩니다(예: 필수 문서의 통제를 위한 서명 요구, 21 CFR 820.40 참조).
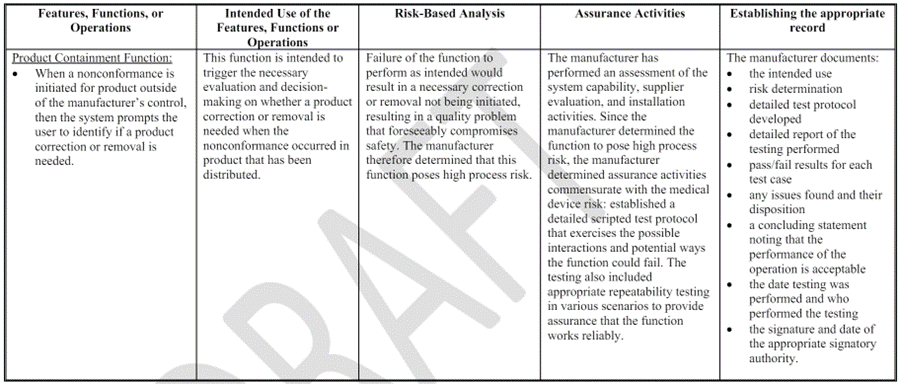
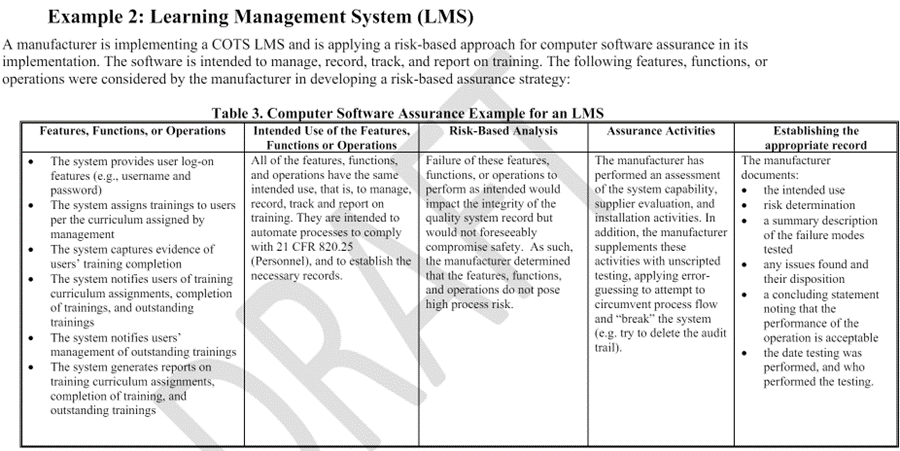
Appendix A


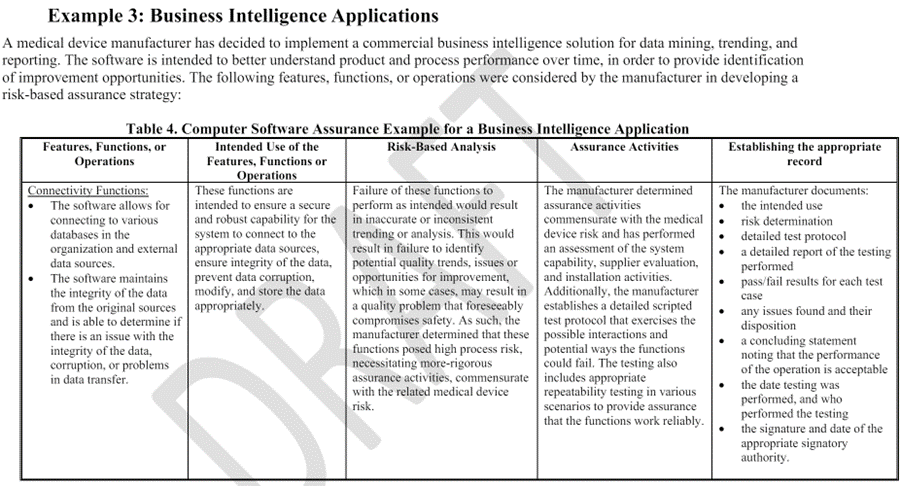
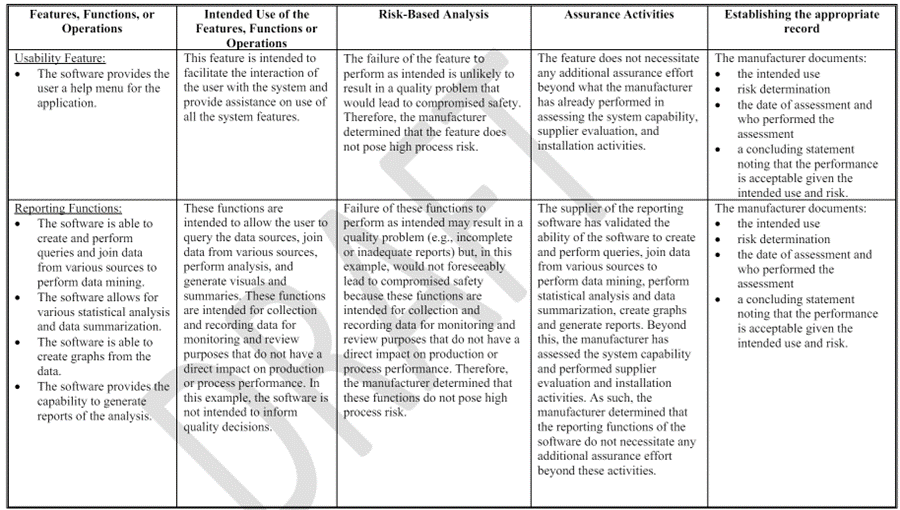
기존 CSV 절차와의 차이점과 CSA 접근 방향에 대해서는 별도 포스팅하겠습니다.
'데이터 완전성 (Data Integrity)' 카테고리의 다른 글
| 변경관리에서의 DI 영향 평가 항목 (8) | 2024.06.20 |
|---|---|
| 원본과 정본 (Original data vs. true copy) (0) | 2024.06.17 |
| 동아ST DI 강연 summary (킨텍스 세미나) (0) | 2024.05.08 |
| SK바이오사이언스 DI 강연 summary (icpi week 2024) (0) | 2024.04.29 |
| Audit trail 기능이 없는 장비, 기기, 시스템 처리 방법 (0) | 2024.04.23 |




댓글